por Dr. Paulo Rodrigues
A desorganização neurológica resultante da depleção de Dopamina no sistema nervoso, não só provoca as reconhecidas alterações motoras da Doença de Parkinson, como também não poupa os sistemas urinário e intestinal.
Pacientes acometidos por Doença de Parkinson idiopática frequentemente apresentam sintomas urinários.
A Doença de Parkinson atinge cerca de 2% da população aos 65 anos (Olanow CW et cols. The scientific and clinical basis for the treatment of Parkinson disease. Neurology 2009; 72: S1-S136), mas cerca de 4% aos 80 anos, tornando-se difícil se diferenciar, se os sintomas urinários são provenientes da Doença de Parkinson ou do crescimento da próstata; provocado pelo seu crescimento progressivo com a idade; a saber: Hiperplasia Benigna da Próstata (HBP).
Estima-se que o número de pacientes com Doença de Parkinson, dobrará por volta de 2030 (Soh SE et als. Determinants of healthrelated quality of life in Parkinson’s disease: a systematic review. Parkinsonism Relat Disord. 2011;17:1-9).
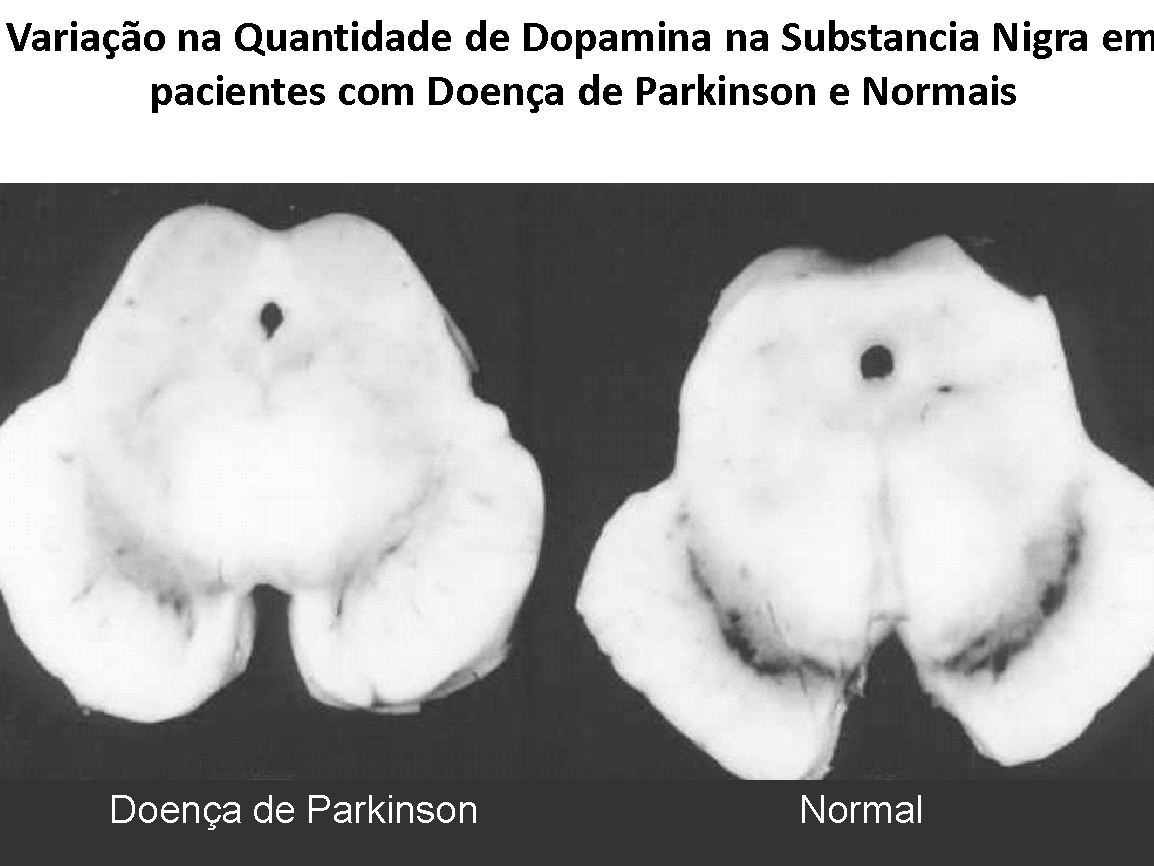
A Doença de Parkinson é uma doença neurodegenerativa do sistema extra-piradamidal com marcante apresentação clínica motora clássica caracterizada por rigidez postural marcante, tremor de repouso – em geral nas mãos; dificuldade de iniciar os movimentos voluntários e perda progressiva da expressão facial. O achado histológico clássico é a diminuição da quantidade de Dopamina nos neurônios destas vias neurológicas, com diminuição mais marcante na Substância Nigra, particularmente na camada ventro-lateral chamada de Pars Compacta.
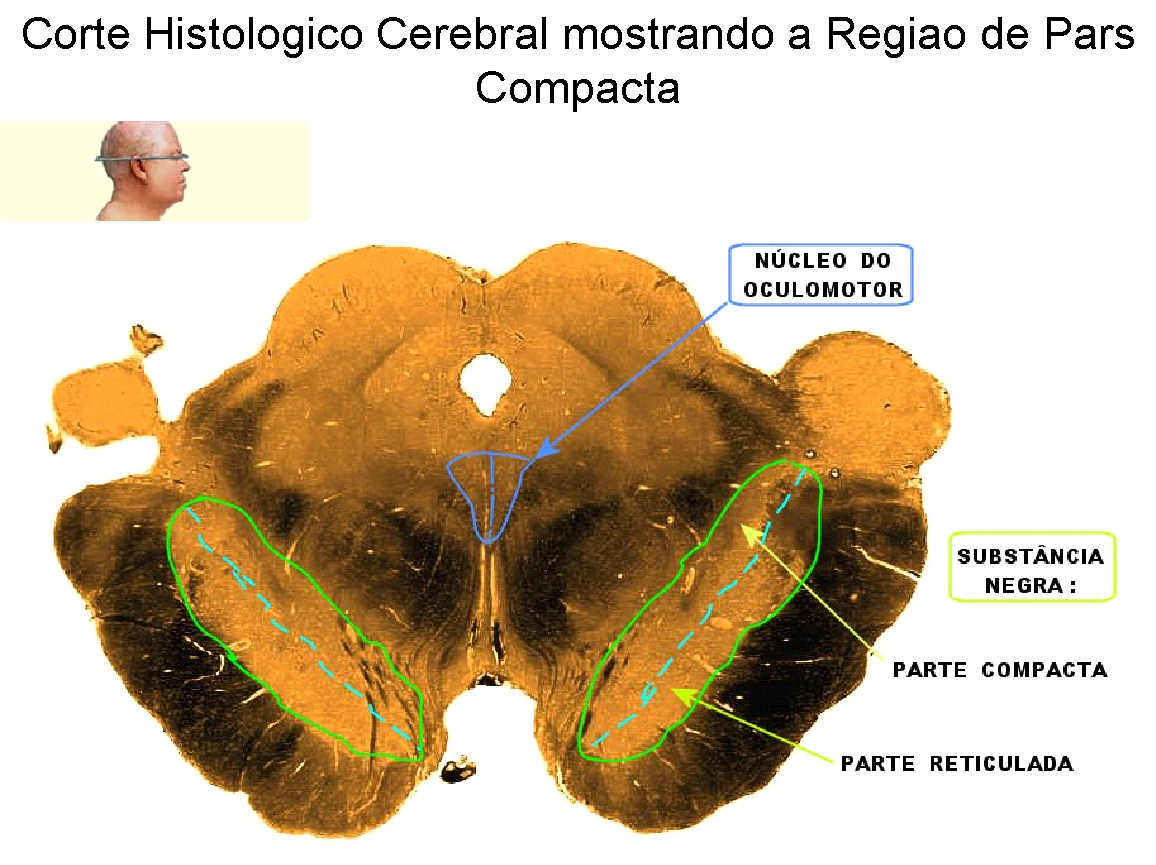
Quando estes sinais estão evidentes, o diagnóstico da Doença de Parkinson torna-se fácil, mas cerca de 50% dos neurônios dos tratos Nigro-striatal já se degeneraram, revelando que a doença já estava presente bem antes disto. Estudos em cadáveres revelam reduções de até 80% do conteúdo de Dopamina.
As manifestações motoras iniciais, tais como os tremores podem ser facilmente controlados com a reposição de Dopamina, mas o uso continuado desta Dopamina, induz à tolerância, exigindo o ajuste de doses maiores e mais frequentes. Ainda assim, o efeito proposto da Dopamina pode ser melhor gerenciado; evitando as indesejáveis flutuações, com a adição de inibidores da enzima COMT (entacapone, tolcapone) para diminuir o metabolismo da Dopamina na sinapse; ou aumentar o tempo de permanência de Dopamina na sinapse com inibidores da enzima MAO-B (selegiline, rasagiline); ou usar agonistas de Dopamina (pramipexole, ropinirole).
Embora os sintomas motores (tremores, rigidez para andar, postura típica) sejam característicos da Doença de Parkinson, os circuitos neurológicos envolvidos na doença alteram também funções de circuitos envolvidos com funções autônomas, tais como urinar, evacuar, engolir, digestão intestinal, controle de pressão arterial, e controle da temperatura corporal, etc.
Como estes sinais também são frequentemente observados em pacientes idosos, muitas vezes estas manifestações são delegadas à idade, e não como manifestações associadas da Doença de Parkinson.
Interessante, quando se comparou 128 pacientes com Doença de Parkinson, com 128 controles sem a doença, com a mesma idade, verificou-se que as alterações observadas nas esferas cárdio-vasculares, queixas urinárias, impotência sexual, queixas intestinais, alterações cognitivas, de memória e ciclos de sono, estavam muito mais alteradas nos pacientes, do que nos seus pares controles. E que estas queixas não guardavam nenhuma relação com a idade, mas com a gravidade do quadro neurológico, demonstrando que a Doença de Parkinson afeta marcantemente o Sistema Nervoso Autônomo (SNA) (Krishnan S et cosl. Do nonmotor symptoms in Parkinson’s disease differ from normal aging Mov Disord. 2011) (Gallagher DA et cols. What are the most important nonmotor symptoms in patients with Parkinson’s disease and are we missing them? Mov Disord. 2010;25:2493-2500).
No cérebro, os circuitos que contém receptores de Dopamina-D1, e mediam a interferência do lobo frontal sobre os gânglios da base ficam alterados; dificultando o controle voluntário do cérebro, que normalmente inibe a vontade de urinar.
No entanto, antes destes sintomas aparecerem e o diagnóstico clínico ser evidente, novos estudos sugerem que outros tratos neuronais, que concentram Dopamina, começam a se atrofiar antes (Braak H et cols. Stages in the development of Parkinson’s disease-related pathology. Cell Tissue Res 2004; 318: 121–34.), causando sintomas diversos, que começam a ser entendidos mais claramente como prenúncios da Doença de Parkinson, que está por vir; com uma antecedência de cerca de 10 anos.
Em geral, estes sintomas não são motores, e confundem-se com uma série de manifestações clínicas, muitas vezes erroneamente relacionadas à idade, hábitos alimentares, e problemas familiares ou sociais, difíceis de serem reconhecidos como pródromos da Doença de Parkinson.
Os sintomas de manifestações precoces da Doença de Parkinson podem ser depressão, fadiga, constipação, anosmia (incapacidade de sentir cheiros) e problemas urinários (Stern MB, Siderowf A. Parkinson’s at risk syndrome: can Parkinson´s disease be predicted? Mov Disord 2010; 25 (suppl 1): S89–93).
Obviamente, outros sintomas também se manifestam como sintomas iniciais da Doença de Parkinson.
Ocorrência de Sintomas Clínicos em Pacientes com Doença de Parkinson e Controles (sem Doença de Parkinson)
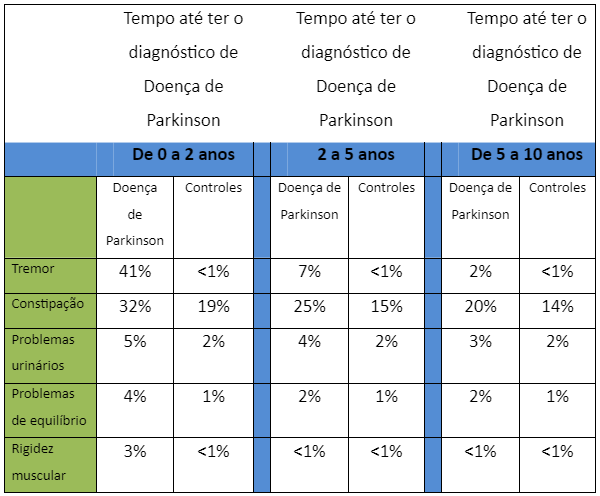
Adaptado de Anette Schrag a et als. Lancet Neurol 2014; 14: 57–64
Particularmente, constipação, problemas urinários e disfunção sexual ocorrem mais comumente nos pacientes que terão Doença de Parkinson nos próximos 10 anos, do que nos pacientes controles (Hawkes CH et cols A timeline for Parkinson´s disease. Parkinsonism Relat Disord 2010; 16: 79–84). Estes 3 sintomas mencionados, representam funções complexas da rede neuronal do sistema nervoso autonômico (SNA) e a desorganização neuronal observada pela deposição da α-sinucleina nos neurônios que controlam o intestino e a bexiga, seriam responsáveis pelo mau funcionamento dos órgãos, causando obstipação (intestino “preso”) e urgência ou dificuldade para urinar (Williams DR, Lees AJ. How do patients with parkinsonism present? A clinicopathological study. Intern Med J 2009; 39: 7–12).
Estas evidências confirmam os novos estudos que mostraram que a Doença de Parkinson manifesta-se em sentido ascendente com centros nervosos mais primitivos sendo afetados primeiro, antes que os centros motores o sejam, quando os tremores e a rigidez corporal ficam mais evidentes, e portanto, o diagnóstico mais evidente de ser feito.
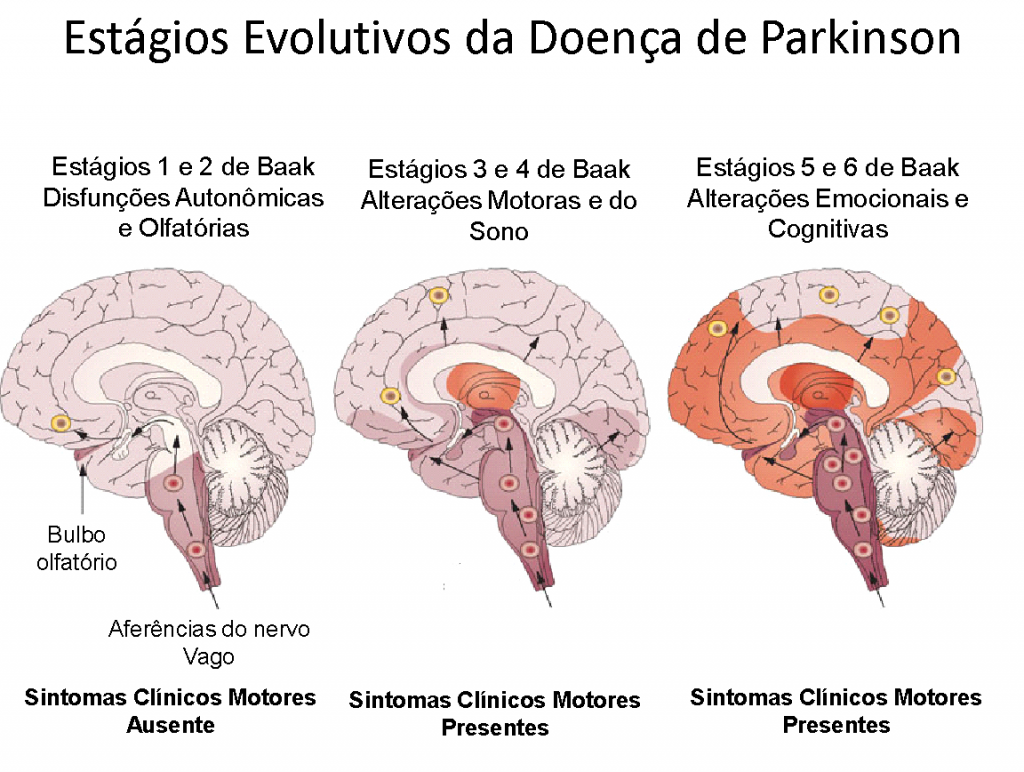
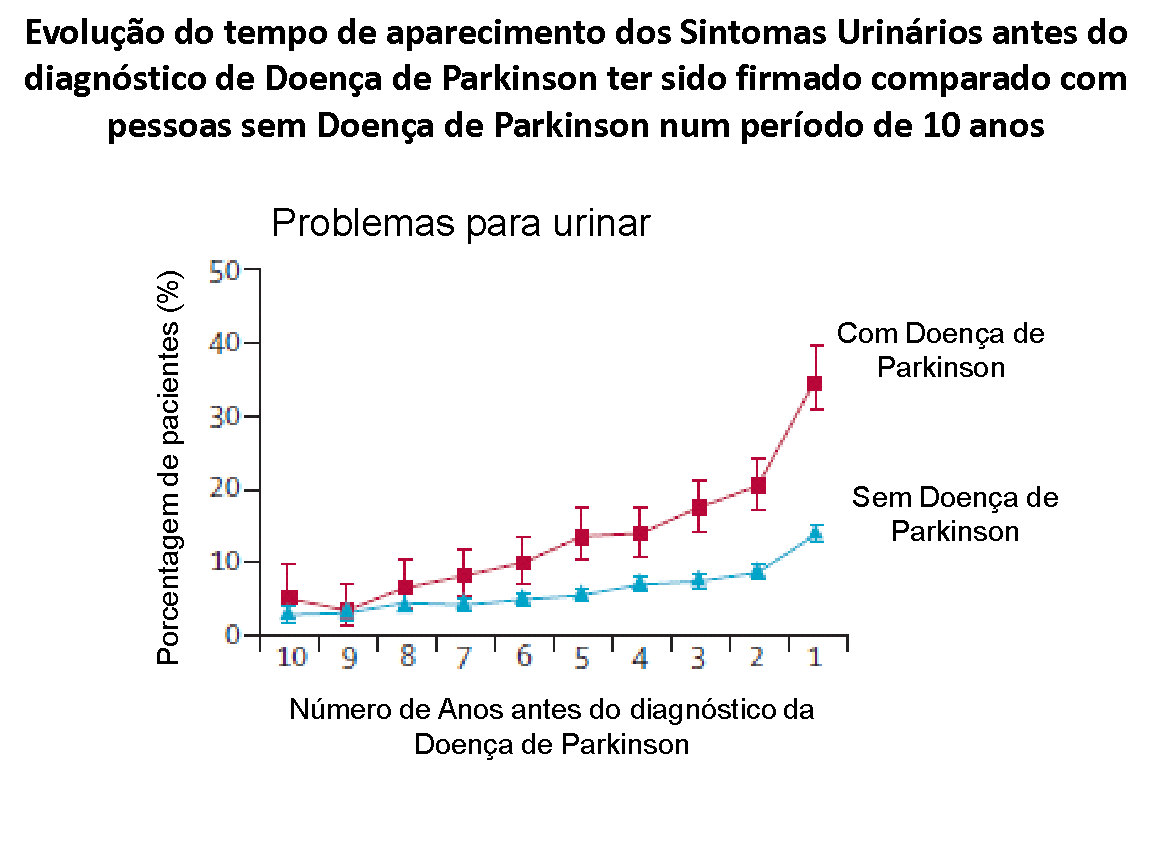
Os sintomas urinários, caracterizados por contrações involuntárias e descoordenadas da bexiga, costumam ocorrer após o quadro clínico motor se manifestar; mas o inverso pode acontecer, havendo casos em que os sintomas urinários antecedem a apresentação clínica da doença ou é mesmo a primeira manifestação de seu início. Alguns estudos observaram que os sintomas urinários são perceptíveis de 5 a 7 anos após o diagnóstico da doença, mas como já mencionado, o aumento da frequência miccional, pode ser bastante precoce; e se confundir com outras situações, enquanto já se trata de uma manifestação muito precoce do processo neurológico (T. Uchiyamaet cols. Urinary dysfunction in early and untreated parkinson’s disease, J. Neurol. Neurosurg. Psychiatry 82 (2011) 1382e1386).
Há fortes indícios de que as manifestações urinárias ou intestinais são pouco reportadas quando o diagnóstico da Doença de Parkinson é confirmado, restando saber que talvez o paciente e seus familiares relevem estas queixas, não estabelecendo uma correlação adequada dos sintomas que já se manifestavam há cerca de 10 anos, com o diagnóstico agora evidente.
O aumento da frequência miccional, noctúria (acordar muitas vezes para urinar) ou a perda involuntária de urina devido à urgência miccional; podem se confundir com problemas urinários relacionados à idade, tais como crescimento da próstata no homem ou “queda da bexiga” na mulher; que também apresentam estes mesmos sintomas, confundindo sua origem e dificultando o diagnóstico; mas precisam ser esclarecidos e diferenciados dos sintomas urinários decorrentes da Doença de Parkinson (Yeo L et cosl. Urinary tract dysfunction in Parkinson’s disease: a review. Int Urol Nephrol. 2012;44:415–424).
Enquanto que cerca de 20% da população adulta apresenta sintomas urinários, na população com Doença de Parkinson, os problemas urinários são observados em 70% dos casos, demonstrando franca relação entre os problemas urinários e a degeneração neurológica (Lemack GE et cols. Questionnaire-based assessment of bladder dysfunction in patients with mild to moderate Parkinson’s disease. Urology 2000; 56: 250–4.). Diferentemente, enquanto os sintomas urinários apresentam piora com a idade na população em geral, nos pacientes com Doença de Parkinson, a piora dos sintomas está relacionada com a piora neurológica, e não com a idade (Sammour ZM et col. Voiding dysfunction in patients with Parkinson’s disease: impact of neurological impairment and clinical parameters. Neurourol. Urodyn. 2009; 28: 510–15); e portanto, os sintomas urinários podem aparecer desde o início da instalação do problema neurológico independentemente da idade, pois relacionam-se com a gravidade da doença.
Sintomas Urinários em pacientes com Doença de Parkinson
| Urgência | (vontade imperiosa de urinar) | 75% |
| Noctúria | (urinar muitas vezes à noite)(mais do que 2x/noite) | 58% |
| Polaciúria | (urinar mais volume à noite do que de dia) | 47% |
| Frequência | (urinar com intervalo menor do que 1 h)(mais que 8 x/durante o dia) | 35% |
| Urge-incontinência | (perda involuntária de urina após sentir vontade de urinar) | 21% |
| Hesitação | (dificuldade para iniciar a micção) | 20% |
| Disúria | (ardor para urinar) | 11% |
| Sensação de micção incompleta | (sensação de bexiga cheia) | 8% |
(Adaptado de S. Kapoor et cols.; Int. J. Urol. 20:79e84, 2013)
Os sintomas urinários mais relevantes concentram-se na incapacidade do individuo em “segurar” ou gerenciar sua vontade de urinar, devido às contrações espásticas da bexiga, que resultam em urgente e imperiosa vontade de urinar. Este processo, conjugado com as dificuldades motoras do paciente, agravam sua dificuldade, pois muitas vezes o paciente não consegue chegar ao banheiro em tempo hábil para urinar a tempo, levando à perdas urinárias involuntárias – urge-incontinência.
Como as quedas representam relevante elemento de complicação clínica para os pacientes com Doença de Parkinson, pacientes com sintomas urinários, do tipo urgência miccional, acordam mais vezes à noite, e são impelidos a procurar o banheiro de maneira apressada, para que não percam urina nas roupas, o que aliado à sua lentidão para andar, aumenta o risco de quedas.
Num estudo que monitorou 97 pacientes com Doença de Parkinson por 6 meses, 50% relataram quedas, que aconteceram quando os pacientes estavam a caminho de urinar – “vontade urgente de urinar” nos 6 meses. Quando se comparou o número de micções/dia, não se verificou que a frequência de urinar impactava as micções, mas sim a presença e urgência (Sakushima K et cols. Influence of urinary urgency and other urinary disturbances on falls in Parkinson’s disease. J Neurol Sci. 2016 Jan 15;360:153-7)
O armazenamento de urina na bexiga e o esvaziamento são controlados por 3 centros neurológicos integrados (1- centro sacral de micção (que coordena a contração da bexiga); 2- centro pontino de micção (que sincroniza a contração da musculatura da bexiga com o relaxamento do esfíncter externo);e 3 – córtex cerebral (que gerencia a vontade expressa e voluntária de urinar)), que permitem que a urina seja acumulada na bexiga sob baixa pressão.
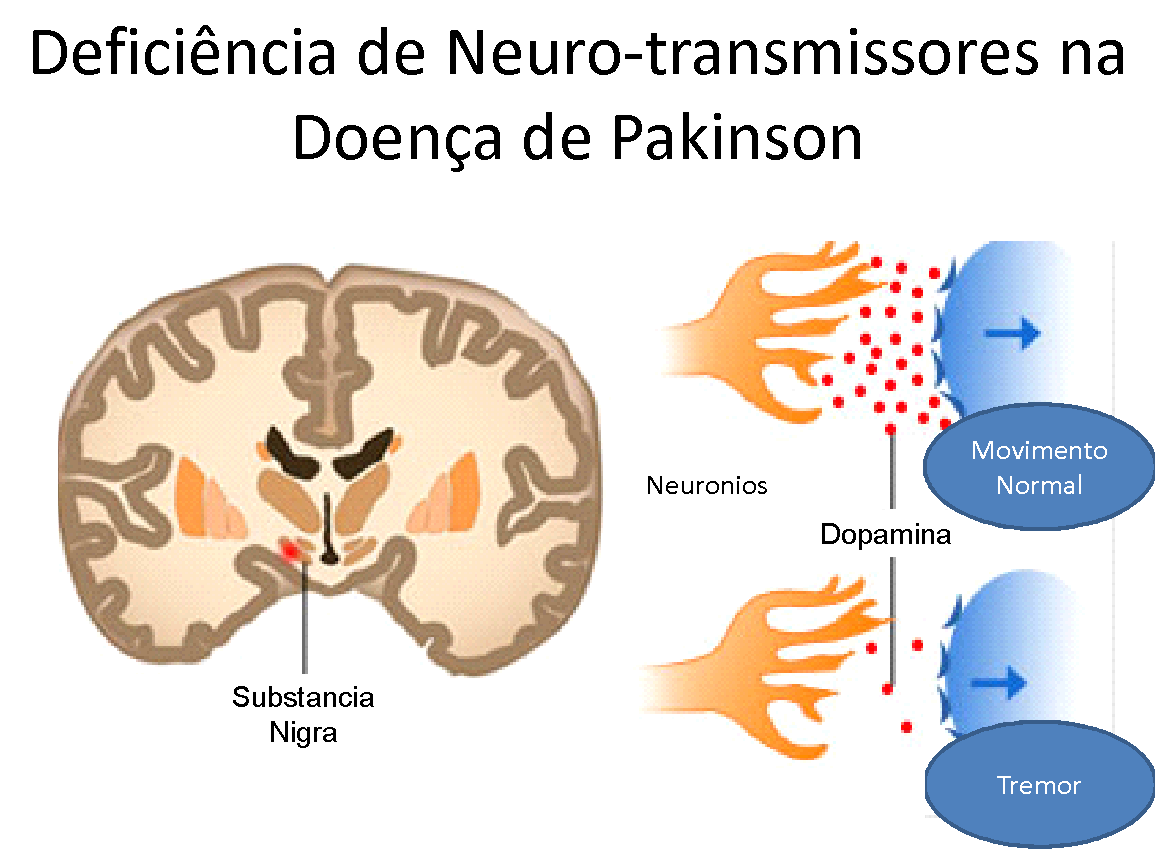
Na Doença de Parkinson, a perda ou diminuição da dopamina cerebral na Substancia Nigra leva à perda do processo inibitório do cérebro sobre bexiga, com consequente ativação ou desinibição dos controles do cérebro sobre a bexiga (Winge K et cols. Effects of dopaminergic treatment on bladder function in Parkinson’s disease. Neurourol. Urodyn. 2004; 23: 689–96). A consequência final desta observação resulta numa bexiga que se contrai involuntariamente, e sem controle; com micções muito frequentes e imperiosas, impactando na qualidade de vida dos pacientes e embaraços sociais devido às perdas urinárias, vulgarmente chamadas de “escapes”.
Sintomas Urinários verificados em pacientes com Doença de Parkinson verificado por vários autores
| Noctúria (acordar à noite) | Urgência miccional | Perdas urinárias involuntárias | Aumento da frequência miccional | Dificuldade para iniciar o jato urinário | Sensação de micção incompleta | |
| Sakakibara | 57% | 48% | 33% | 38% | 38% | 19% |
| Winge | 86% | 68% | 40% | 71% | 14% | 28% |
| Sammour | 91% | 36% | 21% | 35% | 37% | 40% |
A noctúria (acordar para urinar à noite) é o sintoma urinário não-motor mais frequente da Doença de Parkinson, ocorrendo em 80% dos casos (Ragab MM, Mohammed ES. Idiopathic Parkinson’s disease patients at the Urologic Clinic. Neurourol. Urodyn. 2011; 20: 1258–61), mas outros sintomas se somam a este; tais como dificuldade para urinar, sensação de micção incompleta, jato urinário interrompido e fraco e desejo imperioso para urinar.
A noctúria (acordar mais do que 1x à noite para urinar) frequentemente é o resultado da diminuição da capacidade do armazenamento urinário da bexiga durante a fase de sono, quando a bexiga mais fica sem controle cerebral, e as contrações involuntárias, como espasmos, ocorrem de maneira descontrolada e frequente, podendo levar às perdas urinárias na cama, antes que o paciente consiga urinar ou chegar ao banheiro (Sakakibara R et cols. Genitourinary dysfunction in Parkinson’s disease. Mov Disord 2010;25:2–12).
A noctúria, entretanto; também pode ser resultado de uma produção excessiva de urina no período noturno (20 a 35% dos casos). Quando a quantidade de urina produzida a noite é maior que 1/3 da produzida durante o dia, caracteriza-se o diagnóstico de noctúria por poliúria, o que significa que mais urina estaria sendo produzida à noite do que o esperado, sugerindo uma inversão do ciclo de produção de urina.
Número de vezes que o paciente acorda à noite e produção de urina
| 1x | 2x | 3x | 4x ou mais | |
| Tempo com Doença de Parkinson | 9.5 anos | 10.8 anos | 12 anos | 8.4 anos |
| Volume urinado durante a noite | 138 ml | 550 ml | 695 ml | 856 ml |
| Produção de urina nas 24 h | 873 ml | 1.253 ml | 1.782 ml | 2.066 ml |
Como se nota, os sintomas urinários de noctúria, não têm relação com o tempo de diagnóstico da Doença de Parkinson.
Quando se realiza estudo urodinâmico, é possível detectar contrações involuntárias da bexiga em 86% dos casos.
Surpreendentemente, a bexiga hiperativa (contrações involuntárias da bexiga) da fase de armazenamento urinário, ocorre concomitantemente com uma hipocontratilidade detrusora na fase miccional em 20% dos casos de pacientes com Doença de Parkinson (Stocchi F et cols. Urodynamic andneurophysiological evaluation in Parkinson’s disease and multiple system atrophy. J. Neurol. Neurosurg. Psychiatry 1997; 62: 507–11).
Outras causas de disfunções miccionais secundárias incluem a dissinergia vésico-esfincteriana (descoordenação entre a bexiga e o esfíncter) (3%), possivelmente porque o núcleo pontino cerebral (PMC), responsável pela coordenação neurológica da micção é pouco afetado pela Doença de Parkinson, mas não se deve esquecer que levada em consideração que a faixa etária, a hipótese de obstrução uretral provocada pelo crescimento da próstata, não possa ser desprezada (Roth B et cols. Benign prostatic obstruction and parkinson’s disease – should transurethral resection of the prostate be avoided? J. Urol. 2009; 181: 2209–13).
Tratamentos
É importante diferenciar a Doença de Parkinson de outras patologias similares, que se apresentam no início, com o mesmo elenco de sintomas urinários. Estas outras doenças neurológicas degenerativas (Atrofia de Múltiplos Sistemas – M.S.A.; Demência com corpos de Lewis; e Doença de Alzheimer, entre outras); apresentam achados alguns neurológicos que as distinguem da Doença de Parkinson, mas o maior benefício em distingui-las, é que enquanto a Doença de Parkinson progride lentamente, as demais podem cursar mais rapidamente, com achados de hipotonia vesical e esfincteriana mais marcante, o que as diferencia profundamente na forma de tratamento.
Tratamento Conservador
Modificações racionais na ingesta hídrica e comportamentos que facilitem a micção podem promover algum maior grau de controle da bexiga, mas muitas vezes não são suficientes para resolver a situação definitivamente.
Como já mencionado, os sintomas urinários guardam estreita relação com a apresentação e a evolução neurológica da Doença de Parkinson, e embora o tratamento da Doença de Parkinson com Levodopa, promova melhora clínica neurológica, o controle das funções urinárias não é observado. Estudos urodinâmicos realizados antes e após o tratamento com Levodopa para a Doença de Parkinson, revelaram que, infelizmente; não há modificações nos parâmetros urodinâmicos (Winge K et cols. Effects of dopaminergic treatment on bladder function in Parkinson’s disease. Neurourol. Urodyn. 2004; 23: 689–96). Alguns estudos revelam que, na verdade; é a melhora cognitiva e motora que a Levodopa produz, que promoveria a percepção de melhora dos problemas urinários, tal como chegar a tempo no banheiro para urinar.
Infelizmente, a Levodopa não parece produzir uma melhora nos sintomas urinários, sugerindo mais uma vez, a complexidade fisiopatológica dos sistemas neurológicos envolvidos na produção dos sintomas (Uchiyama T et cols. Short-term effect of a single levodopa dose on micturition disturbance in Parkinson’s disease patients with the wearing-off phenomenon. Mov. Disord. 2003; 18: 573–8).
Levodopa e Dopamina
Ao se diagnosticar Doença de Parkinson, é comum se utilizar levodopa ou outro agente que aumente a disponibilidade de Dopamina nas vias neurológicas.
Os resultados quanto aos efeitos na função da bexiga são controversos e contraditórios. Enquanto alguns autores mostraram que a normalização de dopamina cerebral diminui as contrações urinárias involuntárias (Sakakibara R et cols. Questionnaire-based assessment of pelvic organ dysfunction in Parkinson’s disease. Auton. Neurosci. 2001; 92: 76–85); e portanto, maior capacidade de armazenamento de urina, enquanto outros observaram que não houve alterações ou houve até mesmo piora quando utilizaram bromocriptina (Fitzmaurice H et cols. Micturition disturbance in Parkinson’s disease. Br. J. Urol. 1985; 57: 652–6). Enquanto a primeira observação pode estar relacionada pela melhora clínica neurológica; a segunda pode ser decorrente da hipersensibilidade dos receptores pré e pós-sinápticos (Obeso JA et cols. Levodopa motor complications in Parkinson’s disease. Trend Neurosci. 2000; 23: S2–S7).
Anticolinérgicos
Esta classe de medicações apresenta recurso fácil e adequado para o tratamento de bexiga hiperativa, que se manifesta pelo aumento da frequência miccional. Entretanto, efeitos colaterais e alterações cognitivas devem ser lembradas, como efeitos colaterais limitantes nos pacientes com Doença de Parkinson. Colinérgicos (anti-colinesterásicos) com efeito sobre o Sistema Nervoso Central, frequentemente são utilizados para o tratamento de demência (donepezil, rivastigmine), e espera-se que possam exacerbar os efeitos sobre a bexiga, por vias neurológicas de ação central. Em contrapartida, as medicações anticolinérgicas podem agravar o quadro de piora cognitiva, e devem ser considerados com cautela nesta população (Blackett H et cols. Urinary dysfunction in parkinson’s disease: a review, Park. Relat. Disord. 15 (2009) 81e87).
Estimuladores simpáticos beta-específicos
A controvérsia a respeito do uso de anticolinérgicos e suas implicações sobre as capacidades cognitivas em pacientes demenciados ou com doenças neurológicas, acelerou os esforços à procura de alternativas não anti-colinérgicas. Neste pormenor, mirabegron (estimulador de receptores ßeta-3) parece promissor ao relaxar a bexiga; diminuindo o número de episódios de perdas urinárias involuntárias, assim como o número de vezes que o paciente vai ao banheiro, refletindo uma maior capacidade da bexiga em armazenar urina, com maior controle voluntário do cérebro sobre a bexiga (Khullar V et cols Efficacy and tolerability of mirabegron, a beta(3)-adrenoceptor agonist, in patients with overactive bladder: results from a randomised european-australian phase 3 trial, Eur. Urol. 63 (2013) 283e295).
Tratamento Minimamente Invasivo
A aplicação de Toxina Botulínica (Botox®) pretende uma denervação parcial e reversível da musculatura detrusora, com o intuito de que assim, as contrações espásticas vesicais tenham menor amplitude ou desapareçam diminuindo a sensação de urgência para urinar, os “acidentes” de escapes de urina e o aumento da capacidade de reservatório da bexiga (Giannantoni A et cols. Botulinum toxin type A in patients with Parkinson’s disease and refractory overactive bladder. J. Urol. 2011; 186: 960–4.).
Estudos médicos revelaram que a capacidade de armazenamento de urina da bexiga aumenta, diminui o número de episódios de perdas urinárias, diminui o número de episódios de urgência miccional observada no dia-a-dia e aumenta a qualidade de vida medida por questionários validados, surpreendendo que nenhum paciente tenha necessitado utilizar sonda vesical, à exceção de pacientes com Atrofia de Múltiplos Sistemas – M.S.A. (Giannantoni A et cols. Botulinum toxin A for overactive bladder and detrusor muscle overactivity in patients with Parkinson’s disease and multiple system atrophy. J. Urol. 2009; 182: 1453–1457).
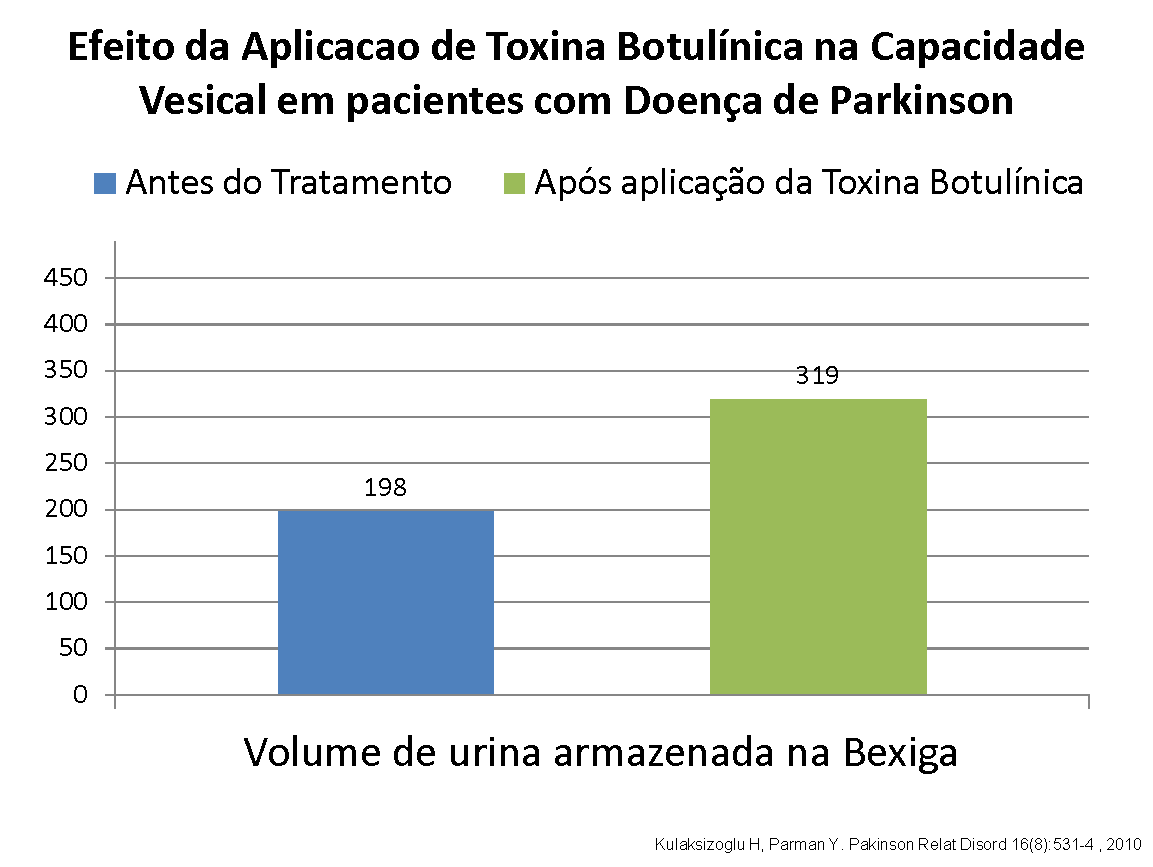
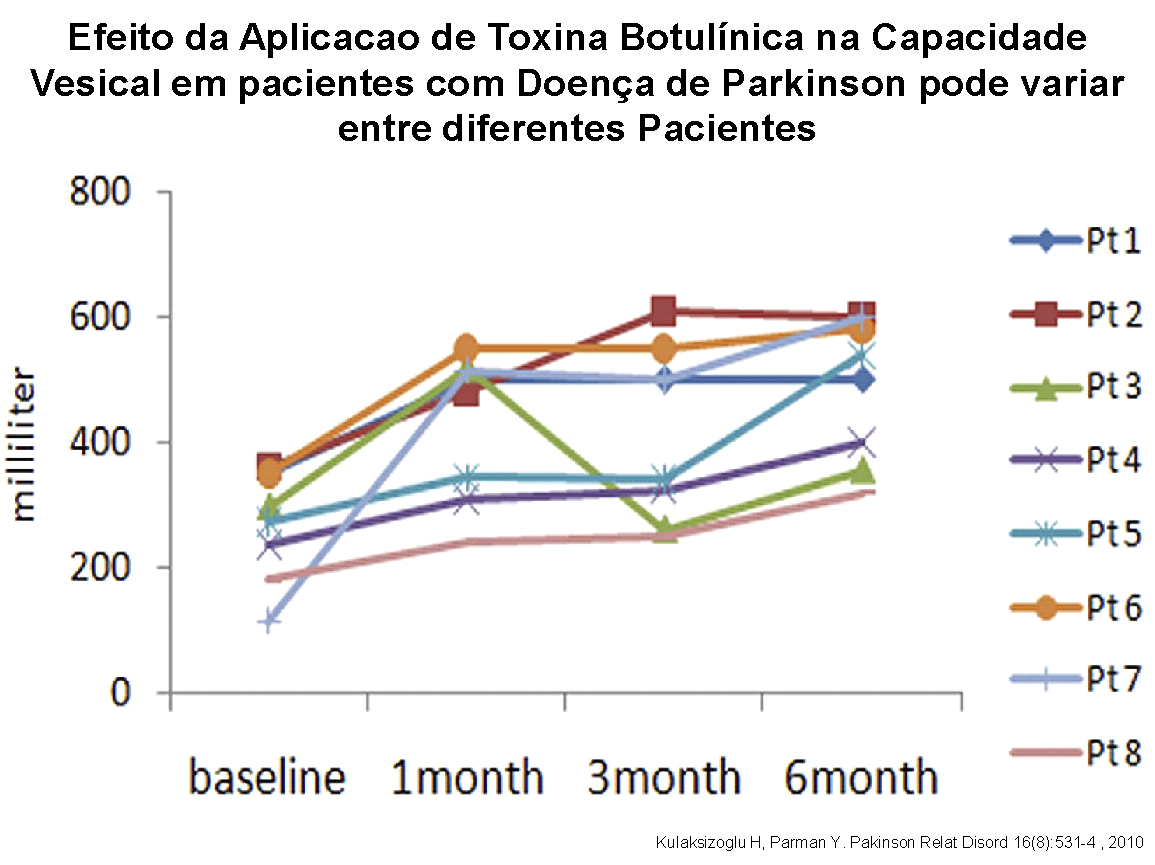
Num estudo exclusivo com pacientes com Doença de Parkinson, 16 casos foram avaliados prospectivamente verificando-se aumento médio da capacidade vesical funcional de 198 ml para 319 ml, o que se refletiu clinicamente em menos episódios de perdas urinárias, melhora na qualidade de vida e menor frequência de idas ao banheiro.
Outro recurso minimamente invasivo utilizado para controlar as manifestações urinárias da Doença de Parkinson é a neuro-modulação sacral ou tibial, que compreendem a estimulação dos nervos aferentes dos membros inferiores, que confluem para o mesmo neurônio aferente da bexiga – a saber, a raiz sacral de S3. A estimulação desta raiz sacral em diversas frequências e amplitudes elétricas parece induzir a um relaxamento da musculatura vesical, com efeito cumulativo, levando à melhora dos sintomas em 50% dos casos e diminuição de 70% dos “escapes” de urina (Krivoborodov GG et cols. Tibial neuromodulation in the treatment of neurogenic detrusor hyperactivity in patients with Parkinson’s disease. Urologiia 2006; 4: 3–6.)
Tratamento Minimamente Invasivo
Como a Doença de Parkinson ocorre mais frequentemente a partir da 4° década de vida, não se deve subestimar eu alguns pacientes tenham sintomas urinários decorrentes da Doença de Parkinson, esquecendo-se da ocorrência do crescimento da próstata, que também ocorre a partir dos 40 anos. Assim é muito importante distinguir ambas as doenças antes de tratá-las.
A não identificação e distinção entre as doenças, como causa dos sintomas urinários, pode resultar em incontinência urinária em 80% dos casos, sobretudo se o paciente tiver M.S.A.; mas que se identificado, apresenta nível de sucesso e resolução dos problemas urinários em 70%, com risco de incontinência urinária de 0% (Roth B et col.s. Benign prostatic obstruction and Parkinson’s disease: should transurethral resection of the prostate be avoided? J Urol 2009;181: 2209–13).
Pacientes com Doença de Parkinson e Internações Hospitalares
Por diferentes motivos, pacientes com Doença de Parkinson são hospitalizados mais frequentemente que pacientes sem a doença – 15%/ano; permanecem internados por períodos mais longos que os demais – em média 5 dias a mais que pacientes hospitalizados sem a doença.
Isto ocorre devido aos vários sistemas orgânicos envolvidos na Doença de Parkinson e apresentam diferentes envolvimentos com as razões pelas quais o paciente foi internado.
O sistema urinário, representado por infecções urinárias desponta como uma das principais causas, representando 1/3 das causas para internação hospitalar; mas confusão mental, quedas e fraturas, e úlceras de pressão; constituem outras importantes complicações, que prolongam o período que o paciente fica hospitalizado (Martignoni E et cols. Comorbid disorders and hospitalisation in Parkinson’s disease: a prospective study. Neurol Sci 2004;25:66–71).
Observou-se que 74% dos pacientes com Doença de Parkinson hospitalizados, descontinuam suas medicações; e por esta razão descontrolam os sintomas da doença, prolongando o período de internação. Também a incompatibilidade de medicações, algumas com efeitos anti-dopaminérgicos, tal com metoclopramida; podem exacerbar os sintomas (Magdalinou KN et cols.. Prescribing medications in Parkinson’s disease (PD) patients during acute admissions to a District General Hospital. Parkinsonism Relat Disord 2007;13: 539–540).
Este grupo de pacientes, quando hospitalizados, apresenta maior vulnerabilidade a quedas (18% vs. 4%), maior risco de infecções urinárias -pela necessidade de colocação de sondas e cateteres (33% vs. 24%) e pneumonia (10% vs. 4%).
No que diz respeito a tratamentos cirúrgicos, o uso ininterrupto das medicações, deve ser monitorada, ao lado de deambulação precoce auxiliada.
Cirurgias endoscópicas têm um lugar de destaque, e se possível com raqui-anestesia, a fim de minimizar os episódios de confusão mental pós-operatórios (Turcotte R et cols. Hip fractures and Parkinson’s disease. A clinical review of 94 fractures treated surgically. Clin Orthop 1990;256:132–136).
A Função Miccional e o Cérebro
A bexiga apresenta 2 funções primordiais: armazenar urina e eliminá-la programadamente.
A bexiga apresenta vários sistemas de controle da sua musculatura, alguns poucos conhecidos como receptores muscarínicos (M2 e M3) e adrenégicos β3, enquanto a uretra tem mais receptores adrenérgicos α-1D e nicotínicos. Estes receptores, cuja função depende do momento envolvido, podem relaxar a bexiga – garantindo assim o enchimento e a supressão da vontade de urinar, ou contraírem a bexiga e abrirem a uretra, de maneira a permitir o esvaziamento completo e voluntário da urina armazenada.
Esta combinação</span de funções depende de uma integração precisa e fina de vários pontos de núcleos neurológicos distribuídos no Sistema Nervoso Central (SNC) e periférico (SNP). Estes núcleos, que funcionam como subestações, conectam-se por vias (cabos) neurológicas, que carregam informações que ajustam estes núcleos, e permitem que a bexiga faca as 2 funções expostas, de maneira finamente coordenadas e sob controle voluntário (de Groat WC. Integrative control of the lower urinary tract: preclinical perspective. BJP 2006; 147: S25–S40).
Na Ponte Cerebral, o Centro de Substância Peri-aqueductal (PAG) parece ser o elemento crítico (interruptor) para que a mudança do modo: armazenamento seja convertido para o modo: esvaziamento da bexiga, influenciando nas vizinhas o Centro Pontino de Micção (PMC), que envia vários sinais sincronizadores para a medula, até a região sacral, onde a coordenação entre a contração da bexiga e a abertura do esfíncter precisa ser perfeita e sincronizada, para que toda a urina seja expelida com mínimo esforço da musculatura da bexiga. Esta mudança de modo é grandemente influenciada pelo córtex cerebral pré-frontal, que em humanos, permite adaptar, programar e ajustar socialmente as melhores condições para urinar (Yamamoto T et cols. Neuronal activities of forebrain structures with respect to bladder contraction in cats. Neurosci. Lett. 2010; 473: 42–7).
Há evidências científicas robustas de conexões diretas entre o córtex pré-frontal e o núcleo pontino da micção, assim como conexões entre o córtex pré-frontal e a Substância Nigra, que compõe os núcleos da base, com muitos neurônios dopaminérgicos.
As conexões do córtex pré-frontal e os núcleos da base têm efeito inibitório sobre a musculatura da bexiga. Quando a bexiga esta se enchendo, há um aumento na concentração de Dopamina nas vias neurológicas descritas – receptores de Dopamina D1; e estas inibem o Centro de Substância Peri-Aqueductal (PAG), evitando que a bexiga comece a se contrair. Os modelos experimentais com animais sugerem fortemente, que a diminuição da capacidade de armazenamento urinário da bexiga e a facilitação para urinar decorrem da falha de estimulação dos receptores D1 (Seki S et cols. Role of dopamine d1 and d2 receptors in the micturition reflex in conscious rats. Neurourol. Urodyn. 20 (2001) 105e113.)
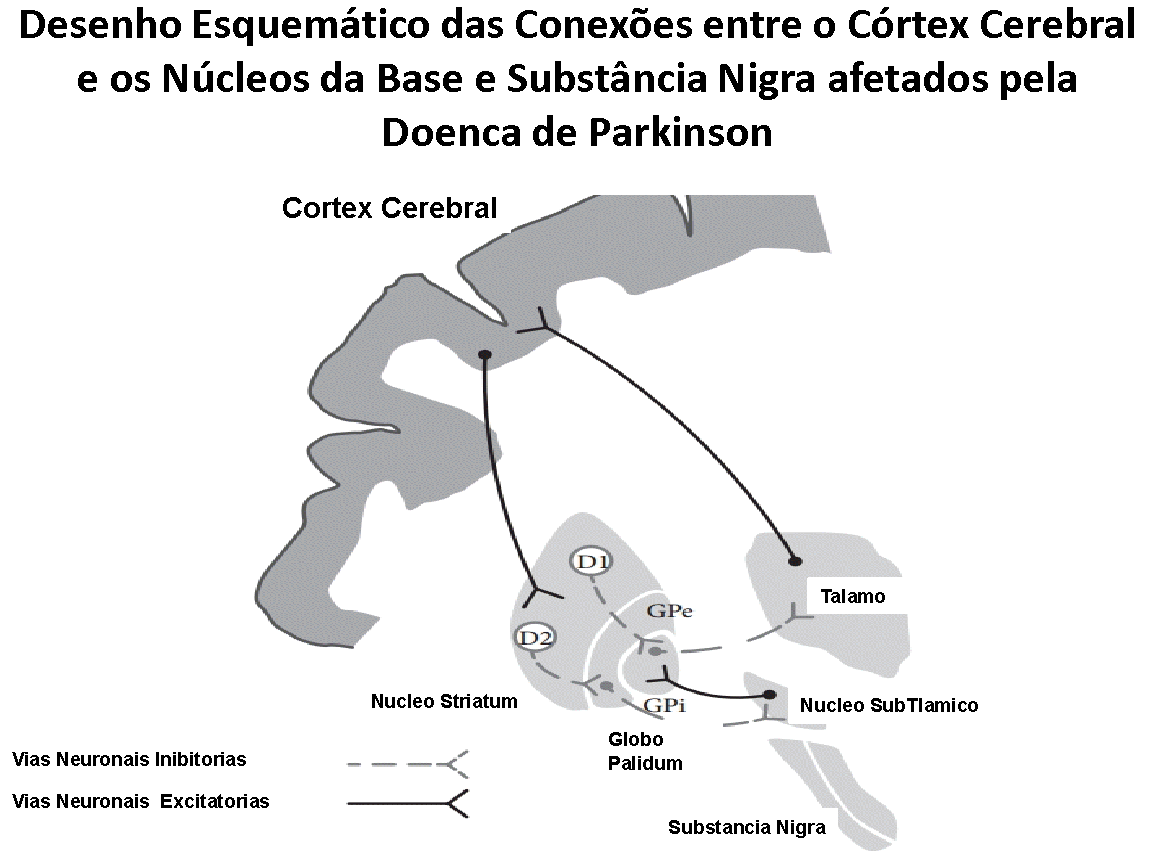
Na Doença de Parkinson, os núcleos da base, francamente afetados; parecem não mais exercerem uma função inibitória sobre a bexiga, e perturbações na quantidade de Dopamina nestes núcleos, promovem uma liberação indevida da bexiga, permitindo que espasmos involuntários ocorram, levando a uma sensação da necessidade urgente e frequente de urinar, pois os circuitos de inibição estão enfraquecidos ou ausentes, podendo resultar em perdas urinárias (Hashimoto K et cols. Neuronal excitation in the ventral tegmental area modulates the micturition reflex mediated via the dopamine D(1) and D(2) receptors in rats. J. Pharmacol. Sci. 2003; 92: 143–8).
Igualmente, há evidências de que o comprometimento do lobo pré-frontal; que é gradativamente ativado durante o enchimento da bexiga, ao ser comprometido pela Doença de Parkinson, libera a função da bexiga, levando-a a se contrair mais precocemente e involuntariamente.
O lobo pré-frontal tem projeções sobre o hipotálamo, córtex singular anterior (ACC) e área cinzenta Peri-Aqueductal. Quando estas conexões estão enfraquecidas, a capacidade de controle voluntário sobre a bexiga, e a programação social, tão inerentemente ligada à condição humana tendem a se relaxar, e observamos que pacientes tendem a urinar sem nenhuma cerimônia, em situações não-apropriadas (Kitta T et cols. Brain activation during detrusor overactivity in patients with Parkinson’s disease: a positron emission tomography study, J Urol 175 (2006) 994e998).
